Estats Units autoritza la primera prova per autodiagnòstic de COVID-19 des de casa
Aquesta nova opció de proves és un important avanç diagnòstic per abordar la pandèmia i reduir la càrrega pública de la transmissió de la malaltia ", ha comentat el comissionat de la FDA, Stephen M. Hahn.
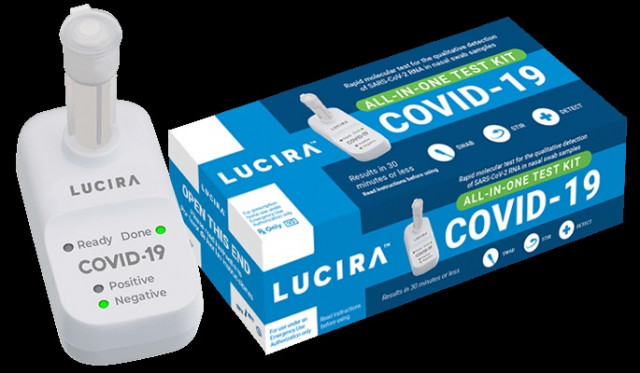
L'Administració d'Aliments i Medicaments dels Estats Units (FDA, per les sigles en anglès) ha emès una autorització d'ús d'emergència (EUA, per les sigles en anglès) per a la primera prova de COVID-19 d'autodiagnòstic a casa i que proporciona resultats en uns 30 minuts.
El kit, de la companyia lluirà, és una prova molecular d'un sol ús que funciona de la següent manera: la persona es pren la mostra amb hisop nasal i la lectura del resultat és un led lluminós en el dispositiu de lectura, que indica positiu o negatiu en COVID-19.
La prova 'lluirà COVID-19 All-In-One Test Kit' ha estat autoritzada per al seu ús a la llar amb mostres d'hisopat nasal en persones de 14 anys o més que són sospitoses de tenir COVID-19 pel seu metge. També està autoritzat per al seu ús en consultoris mèdics, hospitals, centres d'atenció urgent i Urgències per a totes les edats, però les mostres han de ser recollides per un metge quan la prova s'utilitza per examinar els individus menors de 14 anys. En l'actualitat, la prova està autoritzada únicament per al seu ús amb recepta mèdica.
La prova funciona fent girar el hisop de la mostra recollida en un vial que després es col·loca en la unitat de prova. En 30 minuts o menys, els resultats poden llegir-se directament a la pantalla lluminosa de la unitat de prova que mostra si una persona és positiva o negativa per al virus de la SARS-CoV-2.
Els metges que prescriuen la prova estan obligats a comunicar tots els resultats de les proves que reben de les persones que les utilitzen a les seves autoritats de salut pública competents, de conformitat amb els requisits locals, estatals i federals. Lluirà Health, el fabricant de la prova, també ha elaborat un etiquetatge de la caixa, instruccions de consulta ràpida i instruccions per als proveïdors d'atenció de la salut per ajudar a la presentació d'informes.
Segons ha informat la companyia, en un estudi de proves en el qual es va comparar la seva prova amb una d'alta sensibilitat autoritzada per la FDA, el seu test va aconseguir un 94 per cent d'acord percentual positiu (PPA) i un 98 per cent d'acord percentual negatiu (NPA). Excloent les mostres amb nivells molt baixos de virus que possiblement ja no reflectien una infecció activa, lluirà va aconseguir un acord percentual positiu del cent per cent.
"La FDA continua demostrant la seva velocitat sense precedents en resposta a la pandèmia. Tot i que s'han autoritzat les proves de diagnòstic de COVID-19 per a la seva recol·lecció a la llar, aquesta és la primera que pot ser totalment autoadministrada i proporcionar resultats a la llar .
Aquesta nova opció de proves és un important avanç diagnòstic per abordar la pandèmia i reduir la càrrega pública de la transmissió de la malaltia ", ha comentat el comissionat de la FDA, Stephen M. Hahn.

Escriu el teu comentari